Lungenkarzinom
Pneumologie

Hiermit bestätige ich, dass ich einen medizinischen oder pharmazeutischen Beruf ausübe [Ärzt*in, Apotheker*in, Pharmazeutisch-technische*r Assistent*in (PTA), Medizinische*r Fachangestellte*r (MFA)].
Steckbrief
Weltweit und auch in Deutschland ist das Lungenkarzinom die häufigste krebsbedingte Todesursache. Mit etwa 85% ist das nichtkleinzellige Lungenkarzinom der häufigste histologische Typ. Bei ca. der Hälfte aller Patienten liegt bereits ein lokal fortgeschrittenes oder metastasiertes Stadium zum Zeitpunkt der Erstdiagnose vor. Bisher beträgt das mediane Überleben in diesen Stadien etwa 8–18 Monate. Durch die neuen Immuntherapien, auch in Kombination mit Chemotherapie, ist im weiteren Verlauf jedoch mit einer deutlichen Verlängerung dieser Zeitspanne zu rechnen.
Synonyme
- Bronchialkarzinom, Lungenkrebs, bronchogenes Karzinom, Bronchuskarzinom
Keywords
- Lungenkarzinom, Nicht-Kleinzelliges Lungenkarzinom, kleinzelliges Lungenkarzinom
Definition
- maligner epithelialer Tumor, ausgehend von der Bronchialschleimhaut oder dem Alveolarepithel
- Klassifikation über Histopathologie und Molekularpathologie
- Stadieneinteilung
Epidemiologie
- Lungenkarzinome gehören in Deutschland zu den häufigsten malignen Erkrankungen.
- Bei Männern sind sie die zweithäufigsten und bei Frauen die dritthäufigsten Krebserkrankungen.
- Weltweit und in Deutschland ist das Lungenkarzinom die häufigste krebsbedingte Todesursache.
- Die 5-Jahres Überlebensrate beträgt bei Männern etwa 16% und bei Frauen 21%, somit zählt das Lungenkarzinom zu den prognostisch ungünstigsten Krebserkrankungen.
- Die Zahl der krebsbedingten Todesfälle ist bei Männern mit 30000/Jahr etwa doppelt so hoch wie bei Frauen.
- Das mittlere Alter bei Diagnosestellung beträgt etwa 67 Jahre.
Häufigkeit
- Inzidenz: ca. 60/100000
- Prävalenz: 5-Jahres Prävalenz ca. 93500 Einwohner in Deutschland (Stand 2019)
Altersgipfel
- zwischen dem 50. und dem 70. Lebensjahr, mittleres Alter bei Diagnose 67 Jahre
Geschlechtsverteilung
- Männer sind etwa doppelt so häufig betroffen wie Frauen
- seit Ende der 1990er Jahre steigt die Erkrankungsrate bei Frauen kontinuierlich an
- im gleichen Zeitraum fällt die Erkrankungsrate bei Männern ab
Prädisponierende Faktoren
- 85% Inhalatives Rauchen
- 8% Berufsbedingte Karzinogene (z.B. Asbest, Arsen, Nickel, Radon, Chromate, Kohleverbrennungsprodukte)
- 5% Luftverschmutzung
- 2% andere Faktoren (z.B. Röntgenstrahlen, Narben, Ernährung, genetische Ursachen)
Ätiologie und Pathogenese
- bei intensivem Rauchen ca. 20–40% erhöhtes Risiko an einem Lungenkarzinom zu erkranken
- ca. 60% aller Erkrankungen bei Frauen und 90% bei Männern durch Nikotinabusus verursacht
- je tiefer inhaliert wird und je mehr Teer enthalten ist, desto höher das Erkrankungsrisiko
- ca. 16% aller männlichen Raucher und 9% aller weiblichen Raucher erkranken in ihrem Leben am Lungenkarzinom
- Passivrauchen erhöht das Lungenkarzinomrisiko um das 1,5–2-Fache
- nach Aufgabe des Rauchens verringert sich das Risiko kontinuierlich innerhalb von 15 Jahren ohne je wieder das Plateau eines Nicht-Rauchers zu erreichen
- 3-fach erhöhtes Risiko bei Patienten mit einer chronisch obstruktiven Lungenerkrankung
- erhöhtes Risiko bei Patienten mit fibrosierenden Lungenerkrankungen
- genetische Prädisposition u.a. durch p53-Mutationen
- inhalierte Karzinogene führen zur Mutation von Genen, die das Zellwachstum kontrollieren
- entweder Aktivierung von Genen die das Zellwachstum fördern oder Inaktivierung von Tumorsuppressorgenen
- resultierend Hyperplasien, Metaplasien und Dysplasien bis hin zum Carcinoma in situ
- Dysplasien sind durchschnittlich 16 Jahre vor einem invasiven Tumorwachstum nachweisbar, ein Carcinoma in situ etwa 2 Jahre
- inhalatives Rauchen ist nicht nur wichtigster Initialfaktor, auch wichtigster Promotionsfaktor
- häufig weisen Patienten mit Lungenkarzinom viele prämaligne Veränderungen auf, daher häufigeres Auftreten von Zweittumoren
- ab 2–3 mm Größe ist die Angiogenese der limitierende Prozess
- Ansatzpunkt für Angiogenesehemmer
Klassifikation und Risikostratifizierung
Häufigkeit
- Aus therapeutischen Erwägungen heraus wird zwischen dem kleinzelligen (Small Cell Lung Cancer, SCLC) und dem nichtkleinzelligen Lungenkarzinom (Non Small Cell Lung Cancer, NSCLC) unterschieden.
- Als nichtkleinzellige Karzinome werden alle Lungenkarzinome zusammengefasst, die keine kleinzelligen Anteile enthalten und nicht typischen Karzinoidtumoren entsprechen.
- Etwa 85% aller Lungenkarzinome sind nichtkleinzellige Karzinome und 15% kleinzellige Karzinome.
- Die histopathologische Klassifikation des Lungenkarzinoms (Tab. 122.1).
| Tab. 122.1 Histopathologische Klassifikation des Lungenkarzinoms. | |
| Karzinomtyp | Formen |
| Plattenepithelkarzinom |
|
| Adenokarzinom |
|
| großzelliges Karzinom |
|
| kleinzelliges Karzinom |
|
| adenosquamöses Karzinom | |
| sarkomatoides Karzinom |
|
- Die Häufigkeit des Plattenepithelkarzinoms liegt bei durchschnittlich 25%, die des Adenokarzinoms bei 40% und die des großzelligen Karzinoms bei ca. 15%.
- In den letzten 20 Jahren ist der Anteil der Adenokarzinome und kleinzelligen Lungenkarzinomen gestiegen, gleichzeitig sank der Anteil der Plattenepithelkarzinome.
- Der Anstieg der Adenokarzinome ist bei Frauen stärker als bei Männern und betrifft auch Nichtraucher.
- Beachtenswert ist außerdem, dass nur ca. 40% der Lungenkarzinome histologisch homogen sind.
- Die meisten Lungenkarzinome sind histologisch heterogen und bestehen aus Anteilen verschiedener Gewebe.
- In diesen Fällen werden die Tumoren nach der höchstdifferenzierten Histologie klassifiziert.
- Neben der histologischen Klassifikation kann der Grad der Differenzierung des Tumors (Grading) angegeben werden, der jedoch beim Lungenkarzinom nur eine untergeordnete prognostische Bedeutung hat (Tab. 122.2).
| Tab. 122.2 Klassifikation der Tumordifferenzierung beim Lungenkarzinom. | |
| Grading | Bedeutung |
| GX | Grading nicht beurteilbar |
| G1 | hochdifferenzierter Tumor, imitiert das Herkunftsgewebe stark, lichtmikroskopisch eindeutig |
| G2 | mäßig differenziert |
| G3 | schlecht differenziert, Ausgangsgewebe kaum erkennbar, ultrastrukturelle Untersuchungen notwendig |
| G4 | entdifferenzierter Tumor, Herkunft nicht nachweisbar |
|
Hintergundwissen Die R-Klassifikation beschreibt das Fehlen oder Vorhandensein eines Residualtumors nach der Behandlung. Dabei bedeutet:
|
Stadieneinteilung (Staging)
- Die Stadieneinteilung erfolgt beim Lungenkarzinom derzeit nach der 8. revidierten TNM-Klassifikation (Tab. 122.3) [1].
- T: Primärtumor
- N: regionären Lymphknoten
- M: Metastasen
| Tab. 122.3 Übersicht TNM-Klassifikation IASLC Lung Cancer Staging Project [1]. | ||
| Kategorie | Stadium | Kurzbeschreibung |
| T (Tumor) | Tis | Carcinoma in situ |
| T1a | größter Durchmesser ≤1cm | |
| T1b | größter Durchmesser >1cm und ≤2cm | |
| T1c | größter Durchmesser >2cm und ≤3cm | |
| T2a |
|
|
| T2b | größter Durchmesser >4cm und ≤5cm | |
| T3 |
|
|
| T4 |
|
|
| N (Lymphknoten) | N0 | keine Lymphknotenmetastasen |
| N1 | Metastasen in ipsilateralen peribronchialen oder hilären Lymphknoten | |
| N2 | Metastasen in ipsilateralen mediastinalen oder subkarinalen Lymphknoten | |
| N3 | Metastasen in kontralateralen Lymphknoten, tief zervikalen oder supraklavikulären Lymphknoten | |
| M (Metastasen) | M0 | keine Fernmetastasen |
| M1a |
|
|
| M1b | isolierte Fernmetastase in einem extrathorakalen Organ | |
| M1c | mehrere (>1) Fernmetastasen in einem oder mehreren Organen | |
| Die Kategorie M1 kann wie folgt spezifiziert werden: PUL: Lunge, MAR: Knochenmark, OSS: Knochen, PER: Peritoneum, HEP: Leber, ADR: Nebennieren, BRA: Hirn, SKI: Haut, LK: Lymphknoten, PLE: Pleura, OTH: andere Organe | ||
- Auf der Grundlage der TNM-Klassifikation teilt man in Abhängigkeit von der Prognose die Lungenkarzinome in Stadien ein (Tab. 122.4).
| Tab. 122.4 Übersicht Klassifikation der Tumorstadien nach UICC 8 [1]. | |||
| Stadium | Primärtumor | Lymphknoten | Fernmetastasen |
| 0 | Tis | N0 | M0 |
| IA1 | T1a | N0 | M0 |
| IA2 | T1b | N0 | M0 |
| IA3 | T1c | N0 | M0 |
| IB | T2a | N0 | M0 |
| IIA | T2b | N0 | M0 |
| IIB |
T1a-T2b T3 |
N1 N0 |
M0 M0 |
| IIIA |
T1a-T2b T3 T4 |
N2 N1 N0–1 |
M0 M0 M0 |
| IIIB |
T1a-T2b T3–4 |
N3 N2 |
M0 M0 |
| IIIC | T3–4 | N3 | M0 |
| IVA | Jedes T | Jedes N | M1a und b |
| IVB | Jedes T | Jedes N | M1c |
Hintergundwissen
|
- Für die Therapieentscheidung und die Prognose sind entscheidend:
- histologische und molekularpathologische Klassifikation (Tab. 122.1)
- anatomische Ausbreitung des Tumors (TNM-Stadium) (Tab. 122.3)
- Allgemein- und Leistungszustand (Tab. 122.5)
- evtl. vorhandene Begleiterkrankungen und die lungenfunktionelle Reserve des Patienten
- Die Therapieentscheidung soll in einem interdisziplinären Tumorboard, bestehend aus pneumologischen Onkologen, Strahlentherapeuten und Chirurgen, getroffen werden. Wenn möglich sollte die Therapie in einem zertifizierten Lungenkrebszentrum erfolgen.
| Tab. 122.5 Definition des Allgemeinzustandes nach Eastern Cooperative Oncology Group (ECOG) und Karnofsky [2]. | |||
| ECOG | Symptomatik | Karnofsky-Index | Symptomatik |
| 0 | normale körperliche Aktivität, keine besondere Pflege notwendig | 100% | normale körperliche Aktivität, keine Beschwerden, kein Hinweis auf Tumorleiden |
| 1 | mäßig eingeschränkte körperliche Aktivität und Arbeitsfähigkeit, nicht bettlägerig | 90% | geringfügig verminderte Aktivität und Belastbarkeit |
| 80% | normale Aktivität nur mit Anstrengung, deutlich verminderte Aktivität | ||
| 2 | arbeitsunfähig, meist selbstständige Lebensführung, wachsendes Ausmaß an Pflege und Unterstützung notwendig, weniger als 50% bettlägerig | 70% | unfähig zu normaler Aktivität, versorgt sich selbstständig |
| 60% | gelegentliche Hilfe, versorgt sich noch weitgehend selbst | ||
| 3 | unfähig, sich selbst zu versorgen, kontinuierliche Pflege oder Hospitalisierung notwendig, rasche Progredienz des Leidens, mehr als 50% bettlägerig | 50% | ständige Unterstützung und Pflege, häufige ärztliche Hilfe erforderlich |
| 40% | überwiegend bettlägerig, spezielle Hilfe erforderlich | ||
| 4 | 100% krankheitsbedingt bettlägerig | 30% | dauernd bettlägerig, geschulte Pflegekraft notwendig |
| 20% | schwer krank, Hospitalisierung, aktive supportive Therapie | ||
| 10% | moribund | ||
Symptomatik
- keine spezifische Beschwerdesymptomatik
- Allgemeinsymptome: Gewichtsverlust, Inappetenz, Leistungsknick, Fieber, Nachtschweiß, Anämie, Dyspnoe , Husten
- mögliche Beschwerden durch den Primärtumor bedingt (Abb. 122.1), durch die Metastasen (Abb. 122.2) oder paraneoplastische Syndrome
- ob Beschwerden bestehen oder nicht hängt maßgeblich von der Lage des Tumors im Bronchialsystem ab sowie von der Lage der Metastasen (Tab. 122.6 und Tab. 122.7)
- ca. 15% aller Patienten haben keinerlei Beschwerden, hier wird die Diagnose als Zufallsbefund gestellt, z.B. in einem präoperativen Röntgen-Thorax
- Metastasierungsmuster (in abnehmender Häufigkeit): regionäre Lymphknoten, Leber, Nebenniere, Gehirn, Skelett, Nieren, Pankreas
- paraneoplastische Syndrome : hervorgerufen durch Hormone oder hormonähnliche Substanzen die vom Tumor oder den Metastasen freigesetzt werden oder immunologische Mechanismen (Tab. 122.8)
- Pancosttumoren: Infiltration der Pleura und Weichteile im Bereich der Lungenspitze, einschließlich Nervenläsionen und Knochendestruktion
- Plexus-brachialis Syndrom: Sensilibitätsausfälle sowie Schmerzen und Schwäche in Schulter und Arm
- Horner-Syndrom: Ptosis, Miosis und Enopthalmus auf der betroffenen Seite
 © Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
© Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
 © Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
© Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
 © Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
© Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
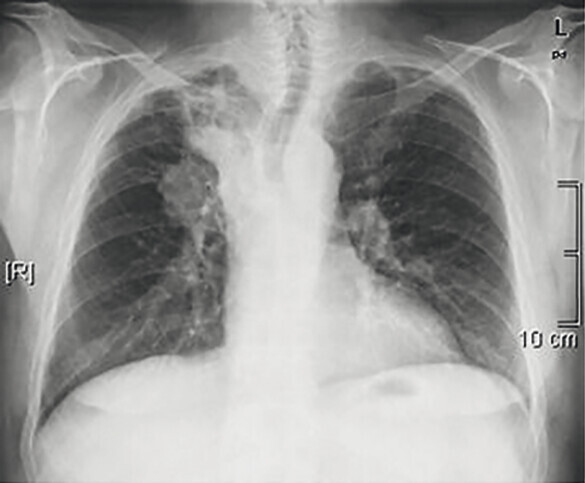
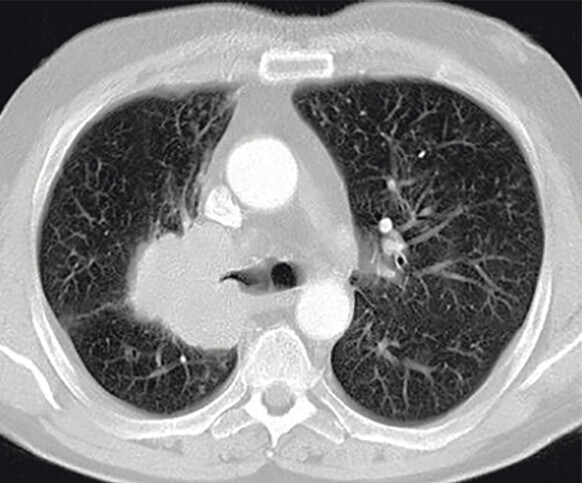
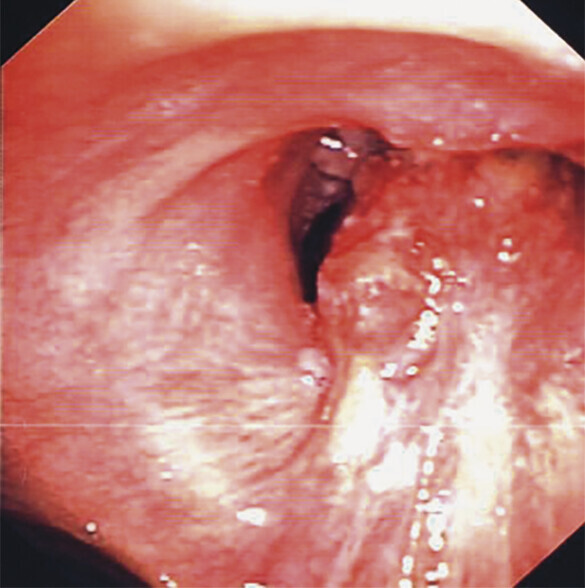
Abb. 122.1 Plattenepithelkarzinom.
62-jähriger Patient, Karzinom rechts zentral. Der Patient wurde stationär aufgenommen wegen Fieber und Husten, verbunden mit blutigem Auswurf.
a Röntgen-Thorax mit suprahilärer Raumforderung und Infiltrat im rechten Oberlappen. (Quelle: Reißig A, Schütte W. Bronchopulmonale Tumoren. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
b CT mit 6,5 × 5,7 × 6,5 cm große Raumforderung rechts zentral. (Quelle: Reißig A, Schütte W. Bronchopulmonale Tumoren. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
c Bronchoskopisch großer endobronchialer Tumor mit Einengung des Bronchus intermedius und Verschluss des rechten Oberlappens. (Quelle: Reißig A, Schütte W. Bronchopulmonale Tumoren. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
 © Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
© Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
 © Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
© Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
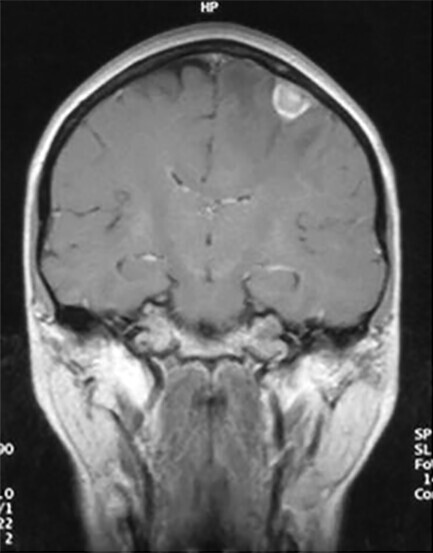
Abb. 122.2 Adenokarzinom im rechten Oberlappen.
51-jährige Patientin. Die zur stationären Aufnahme führende Symptomatik war ein Grandmal-Anfall bei zerebraler Metastasierung.
a MRT mit Hirnmetastase (weitere Metastasen auf anderen Schichten). (Quelle: Reißig A, Schütte W. Bronchopulmonale Tumoren. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
b CT der Lunge mit Raumforderung im 3. Segment rechts. (Quelle: Reißig A, Schütte W. Bronchopulmonale Tumoren. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
| Tab. 122.6 Initialsymptome beim Lungenkarzinom. | |
| Symptom | Häufigkeit |
| blutiger Auswurf | 21% |
| Husten oder Änderung des Hustencharakters | 21% |
| Thoraxschmerzen | 16% |
| Atemnot | 12% |
| extrathorakale Schmerzen | 6% |
| Gewichtsverlust | 5% |
| zervikale Schwellung | 5% |
| obere Einflussstauung | 3% |
| ZNS-Symptome | 3% |
| Tab. 122.7 Symptome bei Patienten mit Lungenkarzinom und ihre möglichen Ursachen. | |
| Symptome | mögliche Ursache |
| Husten, neu aufgetreten oder von anderer Qualität | endobronchiales Tumorwachstum, endobronchiale Stenosierung |
| Hämoptysen | blutender Tumor |
| Fieber | endobronchiale Stenosierung mit Retentionspneumonie, Abszess/Empyem |
| Dyspnoe |
|
| Thoraxschmerzen |
|
| Dysphagie/Aspiration |
|
| Heiserkeit | Arrosion des N. laryngeus recurrens |
| Horner-Syndrom | Arrosion der Spinalnerven C8-Th1 |
| Knochenschmerzen | Knochenmetastasen |
| Wesensveränderung | Hirnmetastasen |
| Schwindel, Kopfschmerzen | Hirnmetastasen |
| neurologische Symptome | Hirnmetastasen |
| abdominelle Beschwerden, Ikterus | Lebermetastasen |
| obere Einflussstauung | Ummauerung und Stenose der V. cava superior |
| Tab. 122.8 Häufigste paraneoplastische Syndrome bei Lungenkarzinom. | ||||
| Bezeichnung | wichtigste Symptome | Pathomechanismus | Vorkommen (bevorzugt) bei | Therapie |
| endokrinologische paraneoplastische Syndrome | ||||
| Syndrom der inadäquaten ADH-Produktion |
|
Sekretion von Arginin-Vasopressin | SCLC |
|
| Cushing-Syndrom |
|
ektope Bildung von ACTH |
SCLC Karzinoide |
|
| Hyperkalzämie | Verwirrtheit | Bildung von „PTH-related peptide“ | Plattenepithel-, Adenokarzinom |
|
| hämatologische paraneoplastische Syndrome | ||||
| Anämie |
|
|
alle Entitäten |
|
| Thrombophilie |
|
|
alle Entitäten | Antikoagulation |
| dermatologische paraneoplastische Syndrome | ||||
| hypertrophische Osteoarthropathie | Trommelschlägelfinger | unbekannt | alle Entitäten, bevorzugt NSCLC | Tumortherapie |
| neurologische paraneoplastische Syndrome | ||||
| Lambert-Eaton-Myasthenie-Syndrom |
|
|
SCLC |
|
| Anti-Hu-Syndrom |
|
Bildung von Anti-Hu-Antikörpern | SCLC |
|
| ACTH: adrenokortikotropes Hormon; SCLC: kleinzellige Lungenkarzinome; NSCLC: nichtkleinzelliges Lungenkarzinom | ||||
Diagnostik
Diagnostisches Vorgehen
- Die zur Diagnose eines Lungenkarzinoms notwendigen Maßnahmen lassen sich in 4 Schritte unterteilen:
- Basisdiagnostik,
- histologische bzw. zytologische Sicherung
- molekularpathologische Klassifikation
- Staging und Abklärung der Operabilität (Abb. 122.3, Abb. 122.4).
- Zu den wichtigsten diagnostischen Maßnahmen zählen das CT-Thorax und Abdomen, das Kopf-MRT, eine Bronchoskopie und ggf. ein PET-CT.
 © Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
© Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
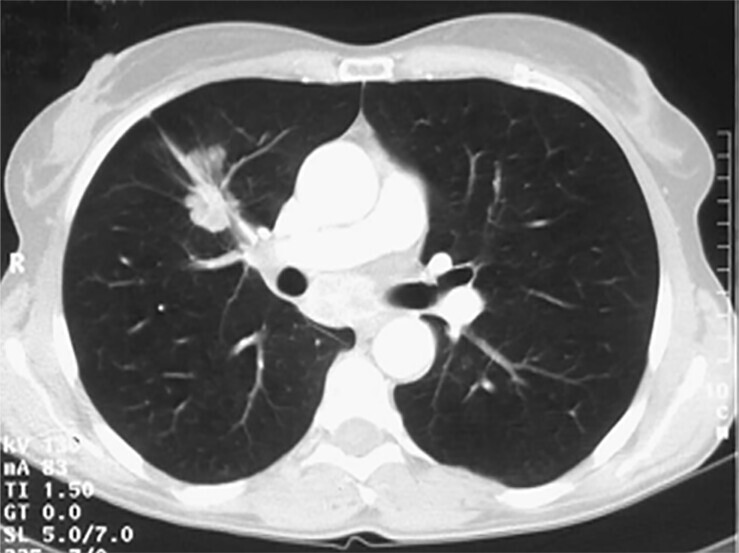
Abb. 122.3 Diagnostisches Vorgehen bei isoliertem Rundherd.
(Quelle: Reißig A, Schütte W. Schritt IV: Abklärung der Operabilität. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146, mit Daten aus [4])
(Quelle: Reißig A, Schütte W. Schritt IV: Abklärung der Operabilität. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146, mit Daten aus [4])
 © Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
© Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
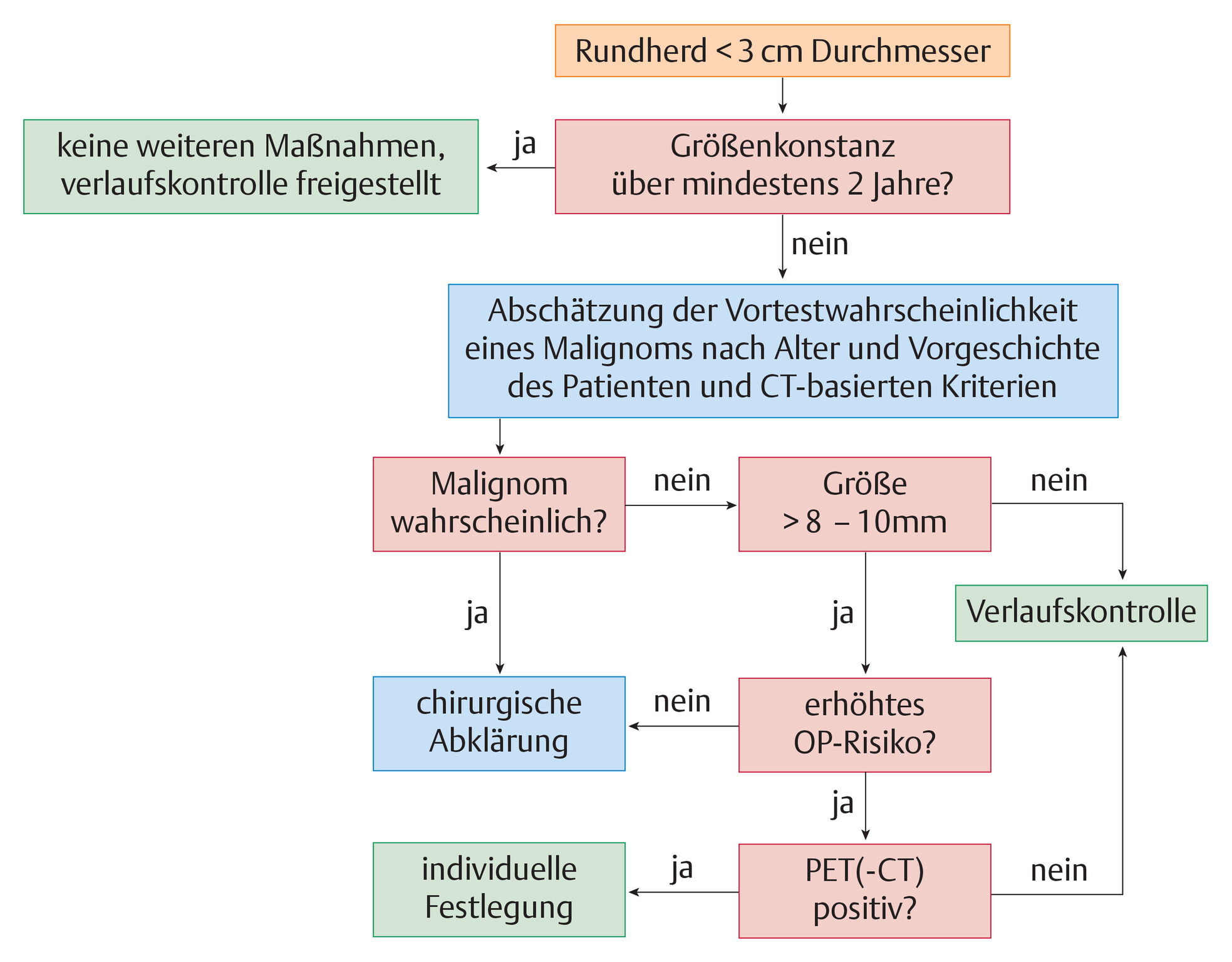
Abb. 122.4 Algorithmus zur Beurteilung der Operabilität vor Lungenresektionen.
FEV1: Einsekundenkapazität; TLCO: CO-Diffusionskapazität der Lunge; ppoFEV1: prädiktive, postoperative FEV1; ppoTLCO: prädiktive postoperative TLCO; VO2max: maximale Sauerstoffaufnahme; ppoVO2max: prädiktive maximale Sauerstoffaufnahme.
(Quelle: Reißig A, Schütte W. Schritt IV: Abklärung der Operabilität. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146, mit Daten aus [4])
(Quelle: Reißig A, Schütte W. Schritt IV: Abklärung der Operabilität. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146, mit Daten aus [4])
Anamnese
- Anamnese sollte die aktuellen Beschwerden des Patienten beinhalten:
- Wann traten die Beschwerden erstmals auf?
- Wie haben sich die Beschwerden entwickelt?
- Erfassung des Raucherstatus: wenn der Patient aktiver oder ehemaliger Raucher ist, dann sollten die Packungsjahre erfragt werden.
- Kontakt zu Schadstoffen (beruflich) sollte erfragt werden sowie mögliches Passivrauchen.
- genetische Belastung erfragen, in dem die Familienanamnese bezüglich maligner Erkrankungen erhoben wird.
- möglichen Komorbiditäten und Anamnese der einzunehmenden Medikamente
Körperliche Untersuchung
- Bei der körperlichen Untersuchung ist vor allem der kardiopulmonale Status wichtig, sowie der Lymphknotenstatus und Leistungszustand (Karnofsky-Index, Tab. 122.5)
Bildgebende Diagnostik
Röntgen
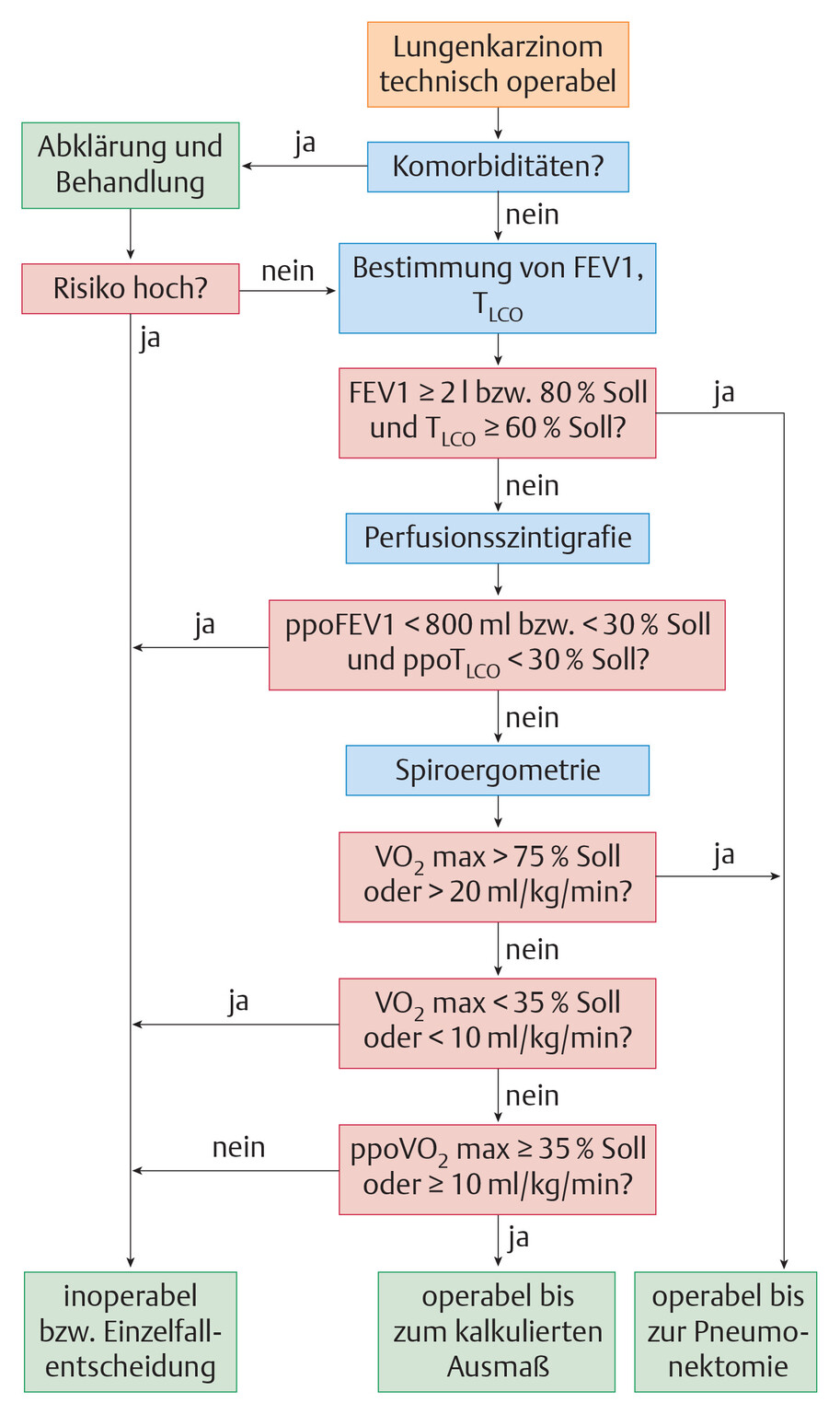
- Mögliche Erscheinungen des Lungenkarzinoms (Abb. 122.5):
- poststenotische Pneumonie
- Atelektase
- Pleuraerguss
- pulmonale Raumforderung
- Tumor in der Lungenspitze
- Pleuratumor
- alveoläres Infiltrat
- Mediastinalverbreiterung
- peripherer Rundherd
- intraluminaler Tumor
 © Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
© Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
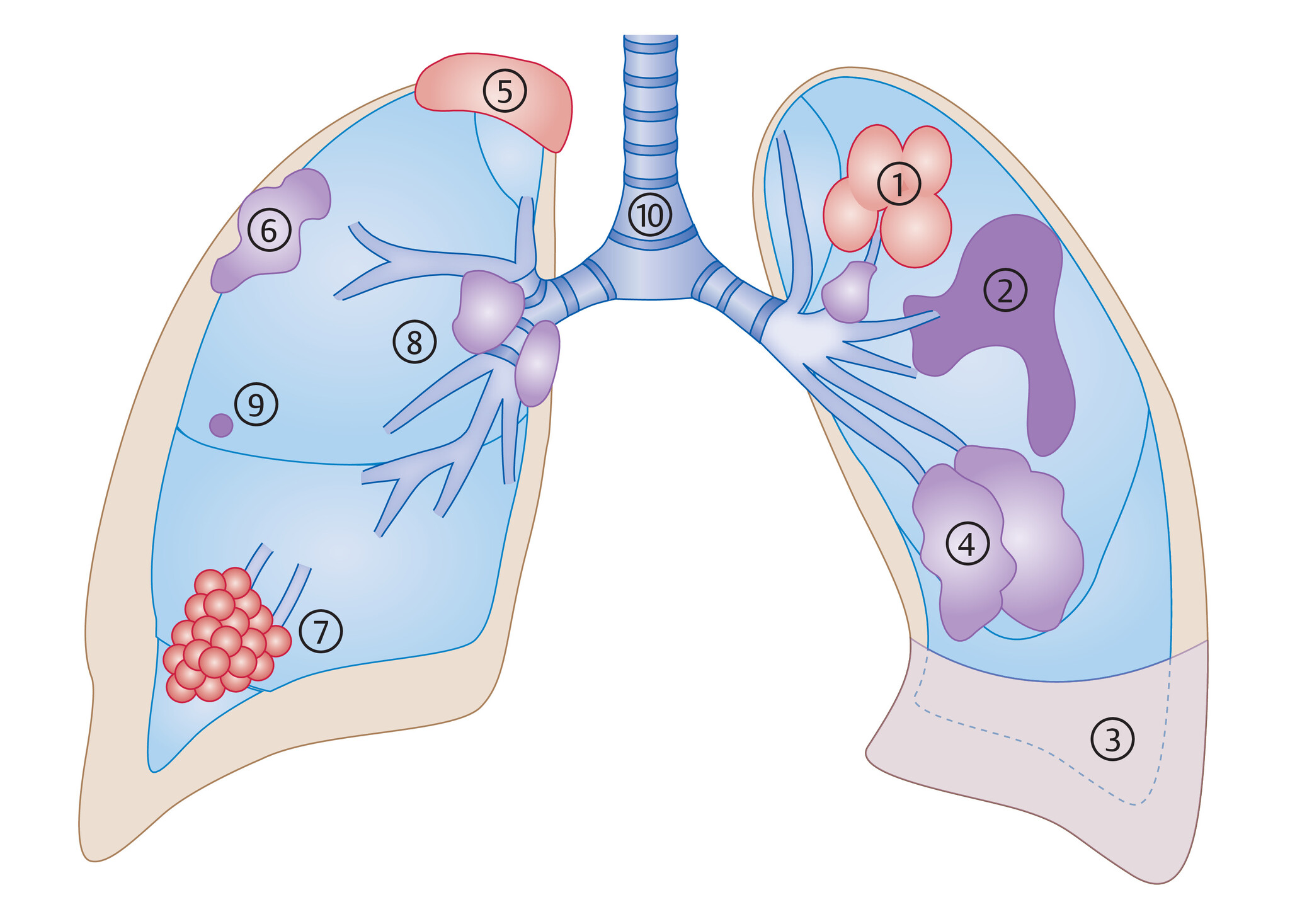
Abb. 122.5 Erscheinungsformen des Lungenkarzinoms.
1: poststenotische Pneumonie; 2: Atelektase; 3: Pleuraerguss; 4: pulmonale Raumforderung; 5: Tumor in der Lungenspitze; 6: Pleuratumor; 7: alveoläres Infiltrat; 8: Mediastinalverbreiterung; 9: peripherer Rundherd; 10: intraluminaler Tumor.
(Quelle: Reißig A, Schütte W. Bronchopulmonale Tumoren. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
(Quelle: Reißig A, Schütte W. Bronchopulmonale Tumoren. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
CT
- CT-Thorax: Methode der Wahl zur Ermittlung des Primärtumors (T-Stadium), Ermittlung des N-Stadiums, Beurteilung ob weitere (z.B. pulmonale Metastasen) vorliegen
- CT-Abdomen: Ausschluss von Leber-, Nebennieren- und weiteren Metastasen (M-Stadium)
- CT-Schädel: Ausschluss von Hirnmetastasen, wenn MRT-Schädel kontraindiziert
MRT
- MRT-Schädel: Methode der Wahl zum Ausschluss von Hirnmetastasen (M-Stadium)
- ggf. MRT von verschiedenen ossären Strukturen bei Metastasenverdacht
Szintigrafie
- eventuell Knochenszintigrafie bei Metastasenverdacht (M-Stadium)
PET/PET-CT
- Die PET/CT ist eine kostenintensive Untersuchungsmethode, mit der Prozesse metabolisch und morphologisch dargestellt werden (Abb. 122.6).
- Vorteil der PET/CT-Untersuchung ist die Beurteilung hinsichtlich der TNM-Klassifikation in einem Untersuchungsgang.
- Für die klinischen Stadien IB-IIIC mit kurativer Behandlungsintention als FDG-PET/CT empfohlen.
- Ebenfalls sinnvoll im Stadium IVA bei atypisch kurativem Behandlungsansatz (Oligometastasierung).
- Die FDG-PET ist aufgrund des hohen Glukoseumsatzes im normalen Hirngewebe für den Nachweis von Hirnmetastasen nicht geeignet.
- Positive PET-Befunde müssen bei therapeutischer Konsequenz bioptisch abgeklärt werden.
- Falsch-positive PET-Befunde treten bei infektiösen und entzündlichen Prozessen auf.
- Negative PET-Befunde müssen nicht histologisch verifiziert werden.
- Bei negativen PET-Befunden ist unter Umständen trotzdem eine Verlaufskontrolle indiziert.
- Die diagnostische Aussagefähigkeit der PET ist eingeschränkt bei:
- Herdbefunden <1cm (neuere Geräte <4mm) Größe
- bei Adenokarzinomen
 © Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
© Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
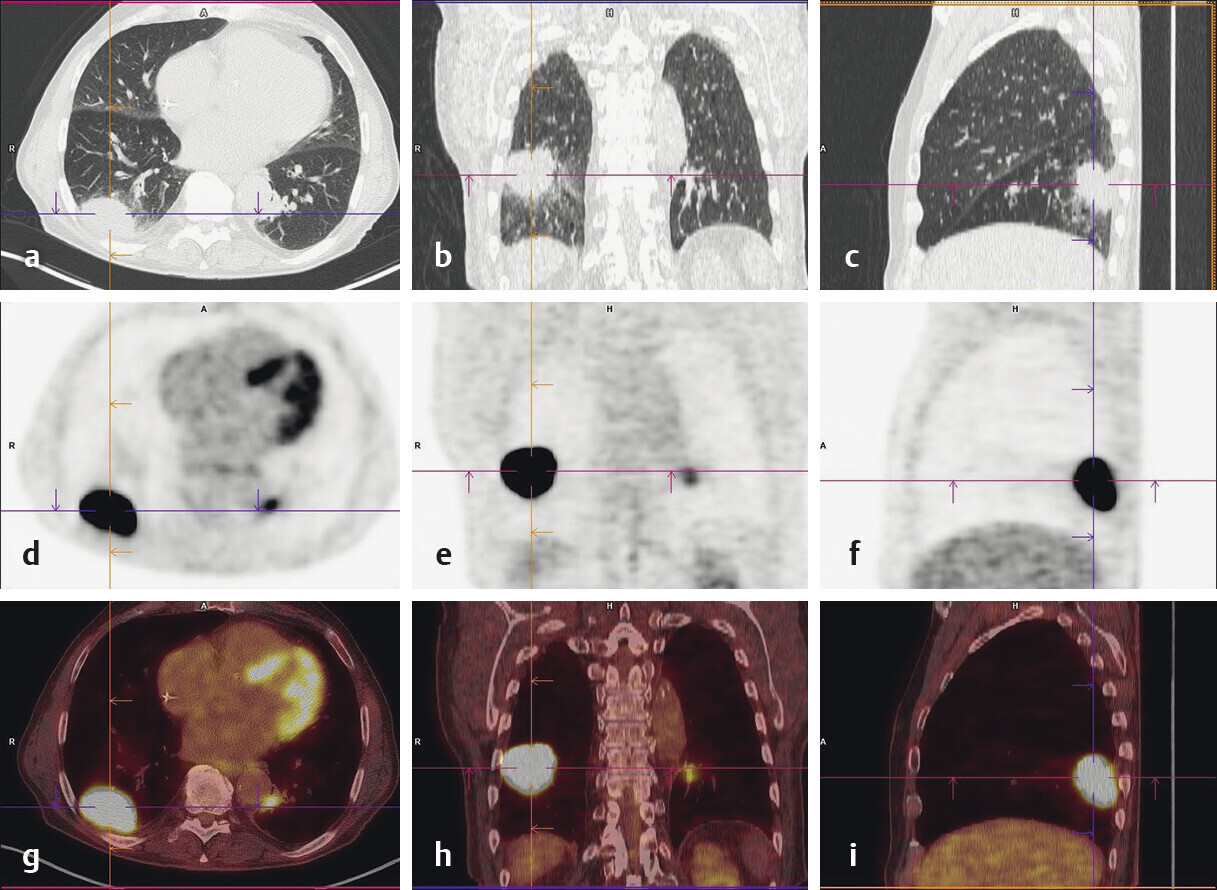
Abb. 122.6 Lungenkarzinom.
53-jähriger Patient nach chronischem Nikotinabusus von 40 Packungsjahren. Im PET-CT zeigt sich ein pleuraständiges Lungenkarzinom rechts dorsal im Mittelfeld (a,b,c: CT; d,e,f: PET; g,h,i: PET/CT).
- Thorakale Sonografie zur Abklärung eines möglichen Pleuraergusses oder bei pleuraständigem Tumor, inklusive transthorakaler Punktion oder Pleurapunktion.
- Abdomensonografie, ggf. mit Kontrastmittel, zur Klärung möglicher abdomineller Metastasen (z.B. Leber), inklusive transkutaner Punktion.
| Merke Die bildgebende Diagnostik des Lungenkarzinoms sollte ein CT-Thorax und Abdomen, ein MRT-Kopf und ein PET-CT beinhalten, sofern eine Metastasierung noch nicht gesichert ist bzw. wenn ein kurativer Ansatz verfolgt wird. |
Instrumentelle Diagnostik
Lungenfunktion- Operabilität bis hin zur Pneumonektomie bei FEV1 mind. 2 Liter bzw. 80% vom Soll und TLCO mind. 60% vom Soll
- Inoperabilität bei FEV1 <800ml bzw. <30% vom Soll; TLCO <30% vom Soll
- Zwischen den beiden o.g. Fällen operabel bis zum kalkulierten Ausmaß (Berechnung der postoperativen FEV1, TLCO, VO2max entsprechend des in der Perfusionsszintigrafie bestimmten Funktionsverlustes nach der geplanten Lungenresektion)
- Bei eingeschränkter FEV1 bzw. TLCO zur Prüfung der Operabilität
- Operabilität bei VO2max >75% Soll oder >20ml/kg/min
- Inoperabilität bzw. Einzelfallentscheidung bei VO2max <35% Soll oder <10ml/kg/min
- zwischen den beiden o.g. Fällen operabel bis zum kalkulierten Ausmaß
- ggf. ergänzend zur Spiroergometrie bei eingeschränkter FEV1 bzw. TLCO zur Prüfung der Operabilität
- sollte bei jedem Patienten mit Verdacht auf Lungenkarzinom durchgeführt werden
- Beurteilung der intrapulmonalen Tumorausbreitung (Beitrag zur T-Klassifikation)
- Fluoreszenzbronchoskopie zur Erfassung früher Tumorstadien
- Kombination mit endobronchialem Ultraschall (EBUS) zur sonografisch gestützten Punktion von Lymphknoten und tumorösen Prozessen
- Ausschluss einer Pleurakarzinose (M-Stadium)
- pleurale und periphere intrapulmonale Prozesse, die mit den vorgenannten Techniken nicht abgeklärt werden konnten
Histologie, Zytologie und klinische Pathologie
Lungenfunktion- EBUS mit transbronchialer Nadelaspiration
- Endosonografie via Ösophagus mit Punktion
- Mediastinoskopie
- Sonografisch gestützte Punktion von außen, z.B. bei supraklavikulären Lymphknoten
- Pleurapunktion zum Nachweis oder Ausschluss eines malignen Pleuraergusses
- Punktion des Primärtumors und/oder der Metastasen zur histologischen Sicherung
- Punktionstechnik und Weg je nach Lage des Malignoms
- Sicherung der Histopathologie des Tumors
- bisher nur beim NSCLC und nicht beim SCLC empfohlen
- Testung aller NSCLCs auf PD-L1
- Testung aller Nicht-Plattenepithelkarzinome auf Treiberalterationen
- Testung aller Plattenepithelkarzinome auf Treiberalterationen, wenn der Patient nicht oder nur wenig geraucht hat (Trend geht zur Testung aller NSCLCs)
- aktuell gezielt behandelbare Treiberalterationen mit zugelassenen Medikamenten: EGFR, ALK, ROS-1, BRAF-V600, NTRK
Differenzialdiagnosen
- benigne Tumore der Lunge
- pulmonale Metastasen bei anderem Primum
- chronische Pneumonien, z.B. kryptogen organisierende Pneumonie
Therapie
Therapeutisches Vorgehen
- Zunächst genaues Staging (TNM) um optimale Therapie festlegen zu können
- Zyto-/histolopathologische Abklärung des Primärtumors, ggf. der Lymphknoten und möglicher Metastasen
- Abklärung einer möglichen Operabilität (Lungenfunktion, Komorbiditäten, ECOG, technisch, etc.) (Abb. 122.4)
- Entscheidung in einem interdisziplinären Tumorboard, wenn möglich innerhalb eines Lungenkrebszentrums
Chemotherapie
- Übersicht über alle Chemotherapeutika (Tab. 122.9)
- Applikation in der Regel intravenös, mit Ausnahme von Nintedanib, welches oral appliziert wird
- Applikationsintervalle verschieden, je nach Kombination, meist Applikation alle 3 Wochen manchmal auch wöchentlich
- z.T. variabel ob man das Schema alle 3 Wochen oder das wöchentliche Schema wählt
- bei schlechterem ECOG eher wöchentlich applizieren, dann ist die Dosis/Gabe nicht so hoch
- Vorteil: weniger Nebenwirkungen durch geringere Dosis/Gabe, leichtere Dosisreduktion möglich durch ausfallen einer Infusion, z.T. bessere Wirksamkeit
- moderne Chemotherapeutika deutlich weniger Nebenwirkungen, sodass meist ambulante Applikation möglich ist
- bspw. ist Nabpaclitaxel eine Weiterentwicklung von Paclitaxel, in dieser Form ist Paclitaxel an körpereigenes Albumin gebunden, dadurch ist das Molekül kleiner und gelangt besser in die Tumorzellen, bessere Wirksamkeit und bessere Verträglichkeit, da kein zusätzliches Lösungsmittel nötig ist
- vor Applikation jedes Chemotherapiezyklus muss die durch die Chemotherapie induzierte Toxizität entsprechend WHO-Kriterien festgestellt werden (Tab. 122.10 und Tab. 122.11)
| Tab. 122.9 Chemotherapeutika beim Lungenkarzinom. | |||
| Alkylanzien | Mitosehemmstoffe | Antimetaboliten | Angiogenesehemmer |
| A: Platinderivate | A: Vincaalkaloide | A: Tyrosinkinase-Inhibitoren | |
|
|
|
|
| B: N-Lost-Derivate | B: Topoisomerase-Inhibitoren | B: VEGF-Antikörper* | |
|
|
Bevacizumab | |
| C: Anthrazykline | C: Taxane | ||
|
|
||
| *VEGF-Antikörper: Vascular Endothelial Growth Factor | |||
| Tab. 122.10 Kriterien* der chemotherapieinduzierten, nicht hämatologischen Toxizität gemäß National Cancer Institute (NCI CTC , [3]). | |||||
| Toxizität | Grad 0 | Grad 1 gering |
Grad 2 mäßig |
Grad 3 schwer |
Grad 4 lebensbedrohlich |
| Übelkeit | keine | fast normale Nahrungsaufnahme | verminderte Nahrungsaufnahme | unzureichende Nahrungsaufnahme | lebensbedrohlich |
| Erbrechen | kein | 1-mal/24h | 2–5x/24h, <24h | >6x/24h, >24h | lebensbedrohlich |
| Diarrhö | kein | <4 Stühle/Tag als vorher | 4–6 Stühle/Tag als vorher | >7 Stühle/Tag als vorher | lebensbedrohlich |
| Stomatitis | keine | schmerzloses Erythem | schmerzhaftes Erythem, Essen möglich | schmerzhaftes Erythem, Essen nicht möglich | parenterale Ernährung nötig |
| Infektion | keine | gering | mäßig | ausgeprägt | lebensbedrohlich |
| Schmerzen | keine | gering | mäßig | stark, ausgeprägt | – |
| Fieber | kein | 38–39°C | >39–40°C | >39–40°C, <24h | >39–40°C, >24h |
| Hauttoxizität | keine | vereinzelte Eruptionen oder asymptomatisches Erythem | vereinzelte Eruptionen oder Erythem mit Juckreiz oder anderen Symptomen | generalisiertes symptomatisches makulöses, papulöses oder vesikuläres Exanthem | exfoliative oder ulzerierende Dermatitis |
| Haarausfall | kein | mild, minimal | ausgeprägt, komplett | – | – |
| Allergie | keine | transientes Erythem, medikamentöses Fieber <38°C | Urticaria, medikamentöses Fieber ≥38°C, geringer Bronchospasmus | Serumkrankheit, Bronchospasmen, parenterale Therapie notwendig | Anaphylaxie |
| CTC: Common Toxicity Criteria; *Grad 5 der NCI CTC = Tod | |||||
| Tab. 122.11 Kriterien der chemotherapieinduzierten hämatologischen Toxizität gemäß National Cancer Institute (NCI), „common toxicity criteria” (CTC), [3]. | |||||
| Veränderung | Grad 0 | Grad 1 gering |
Grad 2 mäßig |
Grad 3 schwer |
Grad 4 lebensbedrohlich |
| Neutropenie | >2×109/l | <2–1,5x 109/l | <1,5–1,0x 109/l | <1,0–0,5x 109/l | <0,5x 109/l |
| Thrombopenie | normal | normal bis 75 × 109/l | <75–50x 109/l | <50–25x 109/l | <25x 109/l |
| Anämie | normal | NW- 6,2 mmol/l | <6,2–4,9mmol/l | <4,9–4,0mmol/l | <4,0mmol/l |
| febrile Neutropenie |
Granulozyten <1,0x 109/l und Fieber >38,5°C Einteilung nach Grad 3 und 4 |
vorhanden | lebensbedrohlich | ||
Immuntherapie
- neueste Säule in der Therapie des Lungenkarzinoms
- Tumorzellen können sich dem Immunsystem entziehen
- Bindung von Tumorzellen am PD-1-Rezeptor (Programmed Death-1) der T-Zelle führt zu deren Inaktivierung
- PD-1-Rezeptor = „Immuncheckpoint“
- Immuntherapeutika = „Immuncheckpointinhibitoren “
- aktuell 5 zugelassene Immuntherapeutika, weitere in Testung im Rahmen von Studien (Tab. 122.12)
- PD-1 Inhibitoren: Nivolumab und Pembrolizumab
- PD-L1 Inhibitoren: Atezolizumab, Durvalumab
- CTLA-4-Antagonist: Ipilimumab (nur First-line in Kombination mit Nivolumab und Chemo zugelassen)
- Erstzulassung eines Immuntherapeutikums für das Lungenkarzinom 07/2015 – Nivolumab beim metastasierten oder fortgeschrittenen Plattenepithelkarzinom nach Versagen einer platinbasierten Chemotherapie unabhängig vom PD-L1 Status [4]
- alle zugelassenen Immuntherapeutika beim (Tab. 122.12)
|
Merke Werden Immuntherapeutika in Kombination mit Chemotherapie gegeben, schließt sich in der Regel nach 4 Zyklen eine Erhaltungstherapie mit dem Immuntherapeutikum an. |
- Fortführung der Erhaltungstherapie bei guter Verträglichkeit ohne zeitliche Begrenzung.
- Beim SCLC aktuell Atezolizumab in Kombination mit Carboplatin/Etoposid in der ersten Therapielinie beim metastasierten oder fortgeschrittenen SCLC zugelassen sowie seit 2020 Durvalumab in Kombination mit Chemotherapie.
- Nebenwirkungen beruhen vor allem auf der Immunsystemaktivierung.
- Negative Folgen bei einer Überaktivierung des Immunsystems äußern sich ähnlich wie bei einer Autoimmunerkrankung.
- Mögliche klinische Bilder:
- Hautausschlag und Vitiligo
- Hypothyreose
- Hyperthyreose
- Pneumonitis
- Kolitis
- Hepatitis
- Nephritis
- Pankreatitis mit nachfolgendem Diabetes mellitus
- Hypophysitis
- Arthritis
- Nebenwirkungen können gut mit lokalen oder systemischen Kortikosteroiden, d.h. immunsuppressiv, behandelt werden
- Je nach Schweregrad kann auch eine Therapieunterbrechung oder ein Abbruch notwendig sein.
| Tab. 122.12 Zulassungen von Immuntherapeutika beim NSCLC, ggf. in Kombination mit anderen Therapien. | |||
| PD-L1 Status | Stadium III, nach RTx/CTx | Stadium IV, Erstlinie | Stadium IV, ab 2. Linie |
| 0% | – |
Pembrolizumab + Platindoublette oder Nivolumab + Ipilimumab + Chemotherapie |
Nivolumab, Atezolizumab |
| 1–49% | Durvalumab |
Pembrolizumab + Platindoublette oder Nivolumab + Ipilimumab + Chemotherapie |
Pembrolizumab, Nivolumab, Atezolizumab |
| ≥50% | Durvalumab |
Pembrolizumab oder Atezolizumab oder Pembrolizumab + Platindoublette oder Nivolumab + Ipilimumab + Chemotherapie oder Cemiplimab |
Pembrolizumab, Nivolumab, Atezolizumab |
Targettherapie
- Gezielte Therapien, die im Gegensatz zur Chemotherapie ganz bestimmte Strukturen der Tumorentwicklung und Progression angreifen.
- Prädiktive Faktoren sind Zielsubstanzen (Targets), die für eine bestimmte Therapie einen Behandlungsvorteil versprechen.
- Aktuell behandelbare Targets mit dafür zugelassenen Substanzen (Tab. 122.13).
| Tab. 122.13 Behandelbare Targets und zugelassene Targettherapien. | ||||||||
| Therapielinie | EGFR | ALK | ROS-1 | BRAF-V600 | NTRK | RET | KRAS G12c | MET-Exon 14 Skipping |
| 1. Therapielinie |
|
|
|
Dabrafenib + Trametinib |
|
|
||
| 2. Therapielinie | Osimertinib bei Nachweis einer T790M Resistenzmutation | Lorlatinib nach Versagen von Ceritinib oder Alectinib oder Crizotinib und einem weiteren TKI |
|
|
|
|||
| TKI: Tyrosinkinaseinhibitor | ||||||||
Epithelial-Growth-Factor Rezeptor (EGFR)
-
Exon 18–21 Mutationen, am häufigsten im Exon 19 oder 2,
-
Insertionen im Exon 20 sprechen nicht auf eine Therapie mit Tyrosinkinaseinhibitoren (TKIs) an.
-
Aktuell 5 zugelassene TKIs (1. Generation Erlotinib und Gefitinib, 2. Generation Afatinib und Dacomitinib und 3. Generation Osimertinib).
-
Häufig bilden sich unter TKI-Therapie weitere Resistenzmutationen:
-
am häufigsten T790M-Resistenzmutationen
-
-
Der einzige TKI der auch bei T790M-Mutation wirkt ist Osimertinib, dieser ist nun auch in der 1. Therapielinie zugelassen, unabhängig davon, ob eine T790M-Resistenzmutation vorliegt oder nicht (bevorzugter Einsatz in der Erstlinientherapie)
-
Medianes Gesamtüberleben 38,6 Monate im Vergleich zu 31,8 Monaten bei Patienten die mit Erlotinib oder Gefitinib behandelt wurden.
-
Medianes progressionsfreies Überleben 18,9 Monate im Vergleich zu 10,2 Monaten in der Kontrollgruppe.
-
Alternativ kann initial eine Therapie mit einem anderen TKI erfolgen und bei Progress mit Nachweis einer T790M-Resistenzmutation auf eine Therapie mit Osimertinib umgestellt werden.
-
T790M-Resistenzmutation kann auch über eine Liquid Biopsy aus dem Blut oder anderen Körperflüssigkeiten (z.B. Pleurapunktat, Urin) nachgewiesen werden, vorausgesetzt es befinden sich Tumorzellen darin.
|
Praxistipp Wichtig bei Progress, wenn möglich Rebiopsie durchführen zum Nachweis möglicher Resistenzmutationen. |
Anaplastische Lymphomkinase (ALK)
-
Eine chromosomale Translokation führt zur Aktivierung von ALK und damit zur Tumorprogression.
-
Aktuell 5 zugelassene TKIs:
-
Erstlinientherapie: Critzotinib, Ceritinib oder Alectinib oder Lorlatinib oder Brigatinib
-
Alectinib besitzt in Bezug auf das PFS, OS und die Nebenwirkungen die günstigsten Eigenschaften
-
-
Zweitlinientherapie: Brigatinib oder Lorlatinib
-
Brigatinib bei Versagen von Critzotinib zugelassen
-
Lorlatinib zugelassen nach Versagen von Alectinib oder Cirtzotinib/Ceritinib + nachfolgend noch mind. 1 weiteren TKI
-
ROS Proto-Onkogen 1 (ROS1)
-
ROS1: Rezeptortyrosinkinase mit struktureller Ähnlichkeit zum Protein der anaplastischen Lymphomkinase (ALK)
-
chromosomale Translokation führt zur Aktivierung von ROS1
-
aktuell Critzotinib für die Therapie zugelassen
-
Wirksamkeit bei ROS1-Translokation auch für Ceritinib, Cabozantinib und Lorlatinib nachgewiesen
BRAF-V600-Mutation
-
Mutation des Gens BRAF im Codon 600
-
zugelassene Therapie Kombination von Dabrafenib und Trametinib
K-ras-Mutation
-
prädiktiv für ein reduziertes Ansprechen auf eine TKI-Therapie
-
viele laufende Studien
-
Zulassung für Sotorasib in der 2. Linie bei pG12C Mutation
NTRK-Genfusion
-
NTRK-Genfusionen kommen bei vielen soliden Tumoren vor
-
aktuell mit Larotrectinib und Entrectinib, 2 zugelassene Substanzen auf Basis von gepoolten klinischen Daten verschiedener Tumorentitäten
Sonstige Targets
-
Weitere Targets welche aktuell im Rahmen von Studien behandelt werden können:
-
MET-Amplifikationen
-
HER2-Amplifikationen
-
Interventionelle Therapie
Kryotherapie
-
Das betroffene endobronchiale Gewebe wird mittels Tiefkühlung zerstört.
-
Eine Hohlsonde wird mit flüssigem Stickstoff durchströmt, die das Gewebe nach Kontakt bei Temperaturen bis –70°C in <1min gefrieren lassen und damit zerstört.
-
An der Sonde anhaftende Tumorpartikel lassen sich unmittelbar entfernen.
-
Zum Teil entstehen jedoch starke Blutungen, weshalb diese Methode bei stenosierenden endobronchialen Tumoren nur bedingt geeignet ist.
Lasertherapie
-
fotothermische Methode zur Tumordestruktion bei endobronchial wachsenden und stenosierenden sowie blutenden Tumoren
-
Umwandlung von energiereichem Licht in Wärme/Hitze
-
Eindringtiefe 5–10mm
-
kontaktlose Methode
-
Koagulation und Vaporisation des Gewebes mit 15–40 Watt
|
Cave Brand- und Explosionsgefahr! O2-Beimischung zur Atemluft max. 40%! |
Stentimplantation
-
Prothese aus unterschiedlichen Materialien zur Sicherstellung des endobronchialen Lumens bei stenosierenden Prozessen (endoluminaler Tumor oder Kompression von außen) oder zur Überbrückung von Fisteln
-
verschiedene Materialien (z.B. Silikon, Nitinol) und verschiedene Formen und Größen verfügbar (z.B. Y-Stent), z.T. individuelle Anfertigung
-
bronchoskopische Implantation
-
Komplikationen: Einwachsen von Tumorgewebe in den Stent, Stentmigration und Sekretverlegung
Strahlentherapie
-
notwendig zur lokalen Kontrolle des Tumors
-
kurative oder palliative Zielsetzung
-
alleinige Radiotherapie: bei kurativem Ansatz mind. 60Gy notwendig
-
Radio-Chemotherapie: Radiotherapie sowie Applikation von 2 Zyklen Chemotherapie, entweder wird die Chemotherapie simultan zur Radiotherapie appliziert oder sequenziell
-
zusätzliche Chemotherapie als Erhaltung hat keinen Vorteil
-
simultane Radio-Chemotherapie: besseres Outcome bei höheren Nebenwirkungen, sollte bei Patienten mit gutem ECOG erfolgen
-
sequenzielle Radio-Chemotherapie: etwas schlechteres Outcome bei weniger Nebenwirkungen, sollte bei Patienten mit reduziertem ECOG erfolgen
-
prophylaktische Hirnbestrahlung: sollte bei Patienten mit SCLC nach kurativer Therapie erfolgen, um verzögert auftretende Hirnmetastasen zu verhindern; Applikation von 30Gy
-
Komplikation: Ösophagitis, Strahlenpneumonitis ca. 1–3 Monate nach Beendigung der Radiatio
-
Strahlenpneumonitis : chronischer nicht produktiver Husten, Dyspnoe, subfebrile Temperaturen; Therapie mit systemischen Kortikosteroiden über mehrere Wochen mit langsamer Dosisreduktion, initial 1mg/kgKG Prednisolonäquivalent
Operative Therapie
Beurteilung der Operabilität
Praxistipp
|
- Die Basisdiagnostik zur Risikoeinschätzung vor lungenresezierenden Eingriffen beinhaltet die Bestimmung der postbronchodilatatorischen FEV1 und der Diffusionskapazität (TLCO).
- Die TLCO korreliert unabhängig von der FEV1 mit einem erhöhten Risiko für pulmonale Komplikationen (TLCO <80%) bzw. einer erhöhten Letalität (TLCO <60%).
- Unter Beachtung der o.g. Voraussetzungen ist bei folgenden Befundkonstellationen keine weitere Diagnostik notwendig:
- für eine Lobektomie, wenn die FEV1 >1,5l (oder >80%) und die TLCO >60%
- für eine Pneumonektomie, wenn die FEV1 >2,0l (oder >80%) und die TLCO >80%
- Für Patienten, die die genannten Werte nicht erreichen, erfolgt eine erweiterte Diagnostik:
- Spiroergometrie (alternativ, wenn eine Spiroergometrie nicht vorgehalten wird, Treppentest oder 6-Minuten-Gehtest mit entsprechend eingeschränkter Aussagekraft)
- Lungenperfusionsszintigrafie mit Bestimmung der prädiktiven postoperativen Lungenfunktion
- Die Spiroergometrie ermöglicht eine exzellente Gesamteinschätzung der kardiopulmonalen Leistungsfähigkeit des Patienten und erlaubt, insbesondere vor einer Pneumonektomie, eine verlässliche Einschätzung des OP-Risikos.
- Aktuell stellt die maximale Sauerstoffaufnahme (VO2peak) das wichtigste Untersuchungsergebnis für die Risikoeinstufung dar.
- Aktuelle Daten legen nahe, dass in Zukunft die Messung des VE/VCO2-slopes an Bedeutung hinsichtlich der Risikostratifizierung gewinnen wird.
- Die Spiroergometrie stellt entsprechend den Leitlinien der europäischen Gesellschaften für Pneumologie und Thoraxchirurgie (ETS/ESTS) den 1. Schritt der erweiterten Diagnostik dar.
- Beträgt der VO2peak >20ml/kg/min oder 75% der Norm, ist eine Resektion bis hin zur Pneumonektomie ohne wesentlich erhöhtes OP-Risiko möglich.
- Bei einer VO2peak <10ml/kg/min oder <35% der Norm, besteht ein deutlich erhöhtes Operationsrisiko für eine Lobektomie, sodass eine sublobäre Resektion oder eine nicht operative Therapie angestrebt werden sollte.
- Liegen die Werte für die VO2peak zwischen 35–75% oder 10–20ml/kg/min, ist die Berechnung der postoperativen Lungenfunktion, basierend auf der Lungenperfusionsszintigrafie notwendig.
Merke |
- Eine Resektion ohne wesentlich erhöhtes OP-Risiko ist möglich, sofern postoperative FEV1 und postoperative TLCO >40% (BTS-Leitlinie bzw. >30% bei ERS/ESTS-Leitlinie) liegen.
- Eine Pneumonektomie ist ohne wesentlich erhöhtes OP-Risiko möglich, wenn sowohl die postoperative FEV1 als auch die postoperative TLCO >40% liegen oder die postoperative VO2max >35% oder 10ml/kg/min.
- Eine präoperative pulmonale Rehabilitation könnte den Anteil der Patienten, denen eine onkologische Operation des Lungenkarzinoms angeboten werden kann, deutlich erhöhen.
- Es konnte in einer prospektiven Studie mit 83 COPD- Patienten gezeigt werden, dass durch eine Rehabilitationsmaßnahme über 2–4 Wochen die FEV1 durchschnittlich um 370ml gesteigert werden konnte. Diese Verbesserung des Lungenfunktionswertes korreliert mit der Verbesserung der Belastbarkeit (6-Minuten-Gehtest).
Chirurgische Standardverfahren
- Lobektomie
- Bilobektomie
- Pneumonektomie , alle jeweils in Verbindung mit einer radikalen Lymphadenektomie.
- Aufgrund der erhöhten Morbidität und Letalität nach Pneumonektomien soll versucht werden durch broncho- und/oder angioplastische Operationen eine Pneumonektomie zu vermeiden – Voraussetzung ist die im Rahmen der intraoperativen Schnellschnittuntersuchung belegte R0-Resektion.
Anatomische Segmentresektion
- Gute Alternative, sofern eine Lobektomie bei eingeschränkter Lungenfunktion nicht möglich ist.
- Für Tumore die einen Durchmesser von <2cm aufweisen erscheint eine anatomische Segmentresektion mit dem Ziel des Erhalts von gesundem Lungengewebe ausreichend sofern eine Negativität für den Prognosefaktor STAS (Tumorspread through airspaces) vorliegt – allerdings stehen die randomisierten Daten zu dieser Fragestellung noch aus.
Erweiterte Pneumonektomie
- Zusätzlich Entfernung der benachbarten Strukturen, wie Brustwand, Perikard oder Vorhof.
Operativer Zugang
- Thorakotomie , videoassistierte Thorakoskopie (VATS), roboterassistierte Thorakoskopie (RATS)
VATS
- Neben kosmetischen Vorteilen sind eine signifikant geringere frühpostoperative Schmerzsymptomatik und eine signifikant bessere frühpostoperative Lungenfunktion gegenüber der Thorakotomie in Studien gut belegt.
- Insbesondere für Patienten mit eingeschränkter Lungenfunktion und multiplen Nebenerkrankungen ist die Erholung in der frühposterativen Phase von entscheidender Bedeutung für das postoperative und onkologische Outcome.
- Zahlreiche Publikationen haben gezeigt, dass das onkologische Outcome nach VATS-Lobektomien zumindest nicht schlechter ist.
RATS
- Die Anwendung der Roboter-Technologie erleichtert die minimalinvasive Operation insbesondere bei technisch anspruchsvollen Segmentresektionen.
- Weitere potenzielle Vorteile sind die technisch einfachere und damit potenziell komplettere Lymphadenektomie sowie potenziell seltenere chronische Schmerzen.
Best Supportive Care
- Neben allen anderen Therapieverfahren ist die Behandlung im Sinne des „best supportive care“ als gleichberechtigte Komponente des Therapiekonzeptes anzusehen.
- Umfassende und sorgfältige Betreuung des Patienten mit einer Minimierung der krankheitsbedingten Beschwerden ohne gezielte Lebensverlängerung.
- Adäquate Schmerztherapie.
- Ernährungstherapie mit hochkalorischer Zusatznahrung bei Gewichtsverlust, ggf. parenterale Ernährung.
- Ausgleich einer Anämie durch Transfusion.
- Palliativmedizinische Komplexbehandlung auf einer Palliativstation (dem Patienten immer frühzeitig anbieten).
Stadienabhängige Therapie beim NSCLC
- Für die stadienabhängige Therapie beim NSCLC findet sich ein Algorithmus unter folgendem Link (Abbildung 6): https://www.onkopedia.com/de/onkopedia/guidelines/lungenkarzinom-nicht-kleinzellig-nsclc/@@guideline/html/index.html; Stand: 28.11.2022
Stadien I und II
- Operation in kurativer Intention ist die Methode der Wahl bei funktioneller und technischer Operabilität
- 5-Jahres Überleben ca. 40–60%
- im Stadium I ist die alleinige Operation indiziert
- im Stadium II sollte sich eine adjuvante Chemotherapie bei gutem ECOG anschließen, wodurch die 5-Jahres Überlebensrate um etwa 5% steigt
- bei Inoperabilität ist die stereotaktische Strahlentherapie die Methode der Wahl
- Lungenfunktion häufig für eine Lobektomie nicht ausreichend, da COPD häufige Komorbidität bei Lungenkarzinom
- Ausnahmefälle: stereotaktische Strahlentherapie kann ohne vorherige histologische Sicherung erfolgen bei hoher Wahrscheinlichkeit für ein primäres Bronchialkarzinom (PET positiver Herd und Größenprogredienz im zeitlichen Verlauf)
- Einsatz der Immuntherapie wird im Rahmen von Studien geprüft, z.B. Durvalumab nach stereotaktischer Strahlentherapie als konsolidierende Therapie oder neoadjuvante Chemotherapie in Kombination mit Atezolizumab in den Stadien IIA und IIB
Stadium III
- heterogenstes Stadium des NSCLC
- multimodale Therapie: Wahl der Therapieverfahren und der Reihenfolge der therapeutischen Maßnahmen wird auf die konkrete Tumorsituation und den individuellen Patienten abgestimmt; multimodale Therapie ist Gegenstand prospektiver randomisierter Studien
- prinzipiell immer Prüfung, ob Operabilität vorliegt
- bei Operabilität sollte sich eine adjuvante Chemotherapie anschließen
- bei operierten Patienten mit N2-Situation sollte eine mediastinale Radiatio erwogen werden
- bei Inoperabilität ist eine Radiochemotherapie die Methode der Wahl
- bei gutem ECOG sollte eine simultane Radiochemotherapie durchgeführt werden (bessere 5-Jahres Überlebensrate bei tendenziell stärkeren Nebenwirkungen)
- bei schlechterem ECOG eine sequenzielle Therapie
- bei PD-L1 Expression ≥1% sollte sich eine konsolidierende Immuntherapie mit Durvalumab für 1 Jahr anschließen
- PACIFIC Studie: signifikante Verlängerung des progressionsfreien Überlebens (HR 0,52; Median 11,2 Monate) und des Gesamtüberlebens [7]
- bei initial inoperablem Patienten kann u.U. durch eine neoadjuvante Therapie doch noch eine operable Situation hergestellt werden
- aktuell auch hier Prüfung des Einsatzes der Immuntherapie im Rahmen von Studien
|
Merke Nach einer potenziell kurativen Radiochemotherapie im Stadium III sollte sich eine konsolidierende Immuntherapie über 1 Jahr bei positivem PD-L1-Status anschließen. |
Stadium IV
- Unterscheidung einer lokalen Metastasierung (z.B. maligner Pleuraerguss, pulmonale Metastasen M1a-Stadium IVA), Oligometastasierung (M1b-Stadium IVA) und einer multiplen Metastasierung (Stadium IVB).
- Bei Oligometastasierung immer Prüfung eines atypisch kurativen Konzeptes, z.B. mit Radiochemotherapie des Primärtumors und der LK-Metastasen sowie OP oder Bestrahlung der Metastase.
- Stadium IVB: palliative systemische Therapie steht im Vordergrund.
- Strahlentherapie und Operation nur als Instrumente z.B. zur Schmerztherapie oder lokalen Kontrolle einzelner Beschwerden verursachender Metastasen.
- Systemische Therapie richtet sich nach Histopathologie und Molekularpathologie
- Medianes Überleben in diesem Stadium 8–18 Monate.
- Durch die neuen Immuntherapien und Targettherapien ist in Zukunft mit einer deutlichen Verlängerung dieser Zeitspanne zu rechnen.
- Bei Patienten mit behandelbaren Treiberalterationen z. medianes Überleben >4 Jahre.
- PD-L1 Testung bei allen Patienten.
- Mutationsanalyse bei allen Patienten mit Nicht-Plattenepithelkarzinom und Patienten mit Plattenepithelkarzinom die nie oder nur wenig geraucht haben (Trend geht zur Testung aller Patienten).
- Therapie entsprechend der nachgewiesenen Treiberalteration entsprechend (Tab. 122.13)
- Ein Algorithmus für die molekular stratifizierte Therapie beim fortgeschrittenen NSCLC findet sich unter folgendem Link: https://www.onkopedia.com/de/onkopedia/guidelines/lungenkarzinom-nicht-kleinzellig-nsclc/@@guideline/html/index.html; Stand: 28.11.2022
- Ohne behandelbare Treiberalteration kombinierte Chemo-/Immuntherapie in der Erstlinie empfohlen (Tab. 122.14)
- Der Algorithmus für die nicht-molekular stratifizierte Therapie beim fortgeschrittenen NSCLC findet sich unter folgendem Link (Abbildung 4): https://www.onkopedia.com/de/onkopedia/guidelines/lungenkarzinom-nicht-kleinzellig-nsclc/@@guideline/html/index.html; Stand: 28.11.2022
- In der Regel 4 Zyklen Chemo-/Immuntherapie mit anschließender Erhaltungstherapie mit dem Immuntherapeutikum (ggf. auch mit einem Chemotherapeutikum, z.B. Pemetrexed).
- Ausnahme: Tumore mit hoher PD-L1 Expression (≥50%), hier ist auch die alleinige Gabe des Immuntherapeutikums Pembrolizumab oder Atezolizumab möglich.
|
Merke Welche Therapie in diesem Fall besser ist, ist nicht sicher geklärt und bleibt dem Behandler überlassen. |
- Von einigen Experten wird favorisiert, trotzdem die kombinierte Therapie zu verabreichen (bei jüngeren Patienten mit gutem ECOG) sowie hohem Therapiedruck (z.B. durch einen schnell wachsenden Tumor in Gefäßnähe o.ä.).
- In der Zweitlinie aktuell Renaissance der Therapien aus einer Kombination von Docetaxel und einem Angiogenesehemmer, entweder Nintedanib oral oder Ramucirumab intravenös (Tab. 122.15).
- Nintedanib ist für Adenokarzinome zugelassen und Ramucirumab unabhängig von der Histologie.
- Nach 4–6 Zyklen Kombinationstherapie ist dann wieder eine Erhaltungstherapie mit dem jeweiligen Angiogenesehemmer möglich.
- Bei Progress unter der Zweitlinientherapie gibt es keine klaren Empfehlungen mehr.
- Von vielen Experten wird nochmals eine Immuntherapie eingesetzt, aber auch die orale Gabe von Erlotinib beim Adenokarzinom und Afatinib beim Plattenepithelkarzinom ist möglich.
- In weiteren Therapielinien sollten dann Substanzen zum Einsatz kommen, die im Vorfeld noch nicht verwendet wurden, im Zweifel können jedoch auch Substanzen eingesetzt werden, welche bereits in einer früheren Therapielinie zum Einsatz kamen, jedoch schon länger nicht mehr gegeben wurden.
- Bei Progress sollte wenn möglich immer eine Rebiopsie erfolgen, da es häufig zu Transformationen des Tumors kommen kann (z.B. Transformation eines Adenokarzinoms zu einem SCLC).
| Tab. 122.14 Therapieschemata Erstlinientherapie beim NSCLC in Abhängigkeit der Histologie und des PD-L1-Status. | ||||
|
Pembrolizumab 200mg absolut |
||||
|
Atezolizumab 1200mg absolut |
||||
|
Pembrolizumab 200mg absolut + Carboplatin AUC5 + Pemetrexed 500mg/m2 |
||||
|
Pembrolizumab 200mg absolut + Carboplatin AUC5 + nab-Paclitaxel 100mg/m2 |
||||
|
Atezolizumab 1200mg absolut + Carboplatin AUC 5 + nab-Paclitaxel |
||||
|
Atezolizumab 1200mg absolut + Carboplatin AUC 5 + nab-Paclitaxel |
||||
|
Nivolumab 360mg + Ipilimumab 1mg/kgKG + Carboplatin AUC 6 + Paclitaxel 200mg/m2 |
Tag 22 /Ipilimumab Tag43 |
|||
|
Nivolumab 360mg + Ipilimumab 1mg/kgKG + Carboplatin AUC 5 oder 6 + Cisplatin 75mg/m2 + Pemetrexed 500mg/m2 |
Tag 22 /Ipilimumab Tag 43 |
|||
| Tab. 122.15 Therapieschemata Zweitlinientherapie beim NSCLC nach initialer Immun-/Chemotherapie in Abhängigkeit der Histologie. | |||
|
Docetaxel 75mg/m2 Nintedanib 2x 200mg oral |
|||
|
Docetaxel 75mg/m2 Ramucirumab 10mg/kgKG |
|||
|
Merke Vor Beginn einer Immuntherapie bzw. Immun-/Chemotherapie sollte immer eine aktivierende Treibermutation bei allen Patienten mit Nicht-Plattenepithelkarzinom ausgeschlossen werden sowie bei allen Patienten mit Plattenepithelkarzinom die wenig oder nicht geraucht haben. Bei Nachweis einer behandelbaren Treiberalteration ist immer diese gezielt zu behandeln, bevor eine andere Therapie gegeben wird. |
Stadienabhängige Therapie beim SCLC
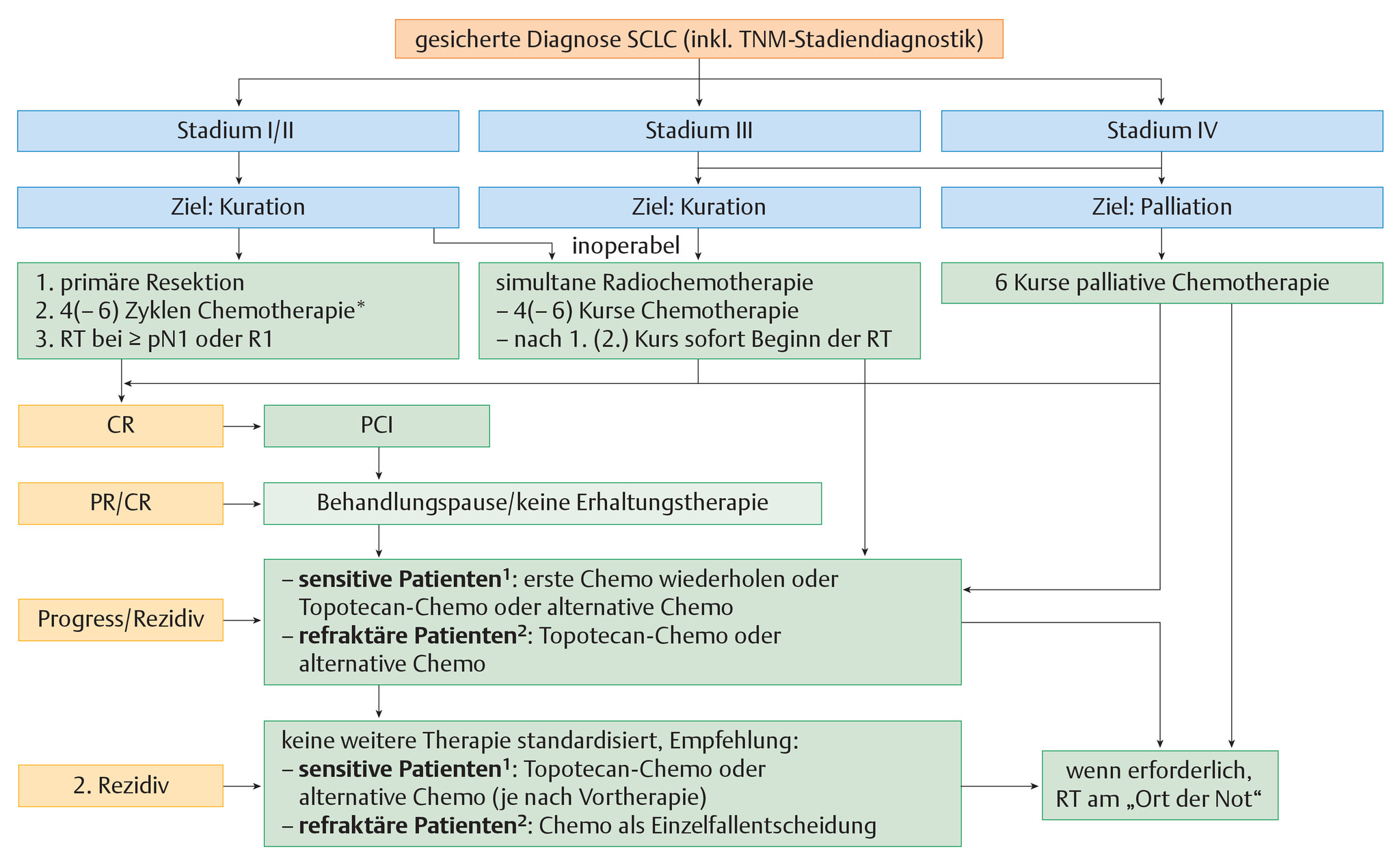
- Abb. 122.7 zeigt die stadienabhängige Therapie des SCLC
 © Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
© Quelle: Schütte W, Möller M, Krüger M. Lungenkarzinom. In: Kroegel C, Costabel U, Bals R, Taube C, Hrsg. Referenz Pneumologie. 1. Auflage. Stuttgart: Thieme; 2024. doi:10.1055/b-006-163265
Abb. 122.7 Stadienabhängige Therapie des kleinzelligen Bronchialkarzinoms.
PR: partielle Remission; CR: komplette Remission; PCI: prophylaktische Hirnbestrahlung; RT: Radiotherapie; 1: „sensitive Patienten“: Rezidiv tritt erst mehr als 3 Monate nach Abschluss der Therapie auf; 2: „refraktäre Patienten“: Rezidiv während der Therapie bzw. innerhalb von 3 Monaten nach Abschluss der Therapie.
(Quelle: Reißig A, Schütte W. Bronchopulmonale Tumoren. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
(Quelle: Reißig A, Schütte W. Bronchopulmonale Tumoren. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
Stadien I und II
- Diagnostizierung in einem so frühen Stadium ist eine Rarität.
- Oft histopathogische Zufallsbefunde im Rahmen der OP eines unklaren Lungenrundherdes, welcher im Vorfeld aufgrund der Lage und Größe nicht histopathologisch gesichert werden konnte.
- Postoperativ 4 Zyklen adjuvante platinhaltige Chemotherapie mit Etoposid empfohlen.
- Falls eine initiale histologische Sicherung erfolgte, kann entweder die OP mit adjuvanter Chemotherapie erfolgen oder eine simultane Radiochemotherapie.
- Adjuvante Schädelbestrahlung sollte erwogen werden.
Stadium III
-
Operative Therapie kommt nicht mehr in Betracht.
-
Radiochemotherapie in kurativer Intention, Radiotherapie entweder simultan oder sequentiell zur Chemotherapie.
-
Applikation von insgesamt 4–6 Zyklen platinhaltiger Chemotherapie mit Etoposid.
-
Adjuvante Schädelbestrahlung sollte erwogen werden.
Stadium IV
-
60% der Patienten haben bei Diagnose bereits ein metastasiertes Tumorstadium.
-
Therapiemöglichkeiten äußerst begrenzt, kaum Fortschritte in der Therapie in den letzten Jahrzehnten im Gegensatz zum NSCLC.
-
5 Jahres Überlebensrate liegt bei 2%.
-
Viele Studien der letzten Jahre waren negativ und führten nicht zur Zulassung neuer Substanzen und Substanzklassen.
-
Bisher war eine platinhaltige Chemotherapie mit Etoposid der Standard.
-
Seit 2019 Zulassung der kombinierten Chemo-/Immuntherapie mit Carboplatin/Etoposid und Atezolizumab (Tab. 122.16)
-
In der IMpower 133-Studie konnte ein medianes Gesamtüberleben von 12,3 Monaten im Studienarm im Vergleich zu 10,3 Monaten im Kontrollarm erreicht werden; medianes progressionsfreies Überleben 5,2 Monate in der Studiengruppe im Vergleich zu 4,3 Monaten, keine vermehrten oder unerwarteten Nebenwirkungen in beiden Armen [8].
-
In der CASPIAN-Studie auch für Durvalumab in Kombination mit platinhaltiger Chemotherapie ein Vorteil im Gesamtüberleben von 13 Monaten in der Durvalumabgruppe im Vergleich zu 10,3 Monaten in der Kontrollgruppe [9].
-
Zweitlinientherapie seit vielen Jahren unverändert.
-
Chemotherapie mit Topotecan hat im Vergleich zu Best Supportive Care zu einem längeren Überleben geführt.
-
Therapie in der Regel nur schlecht verträglich mit sehr hoher Hämatotoxizität und häufigen Therapieabbrüchen.
-
Bei gutem Ansprechen auf die Erstlinientherapie kann eine konsolidierende thorakale Bestrahlung einen Vorteil für die Patienten bringen.
| Tab. 122.16 Therapieschema Erstlinientherapie beim SCLC. | ||
|
Atezolizumab 1200mg absolut Carboplatin AUC 5 Etoposid 120mg/m2 |
Tag 2,3 Etoposid |
|
|
Durvalumab 1500mg + Carboplatin AUC 5 oder 6 Cisplatin 75–80mg/m2 + Etoposid 80–100mg/m2 |
Tag 2,3 Etoposid |
|
Nachsorge
- Überwachung von Patienten nach erfolgtem Abschluss der Primärtherapie.
- Möglichst frühzeitige Diagnose von Zweit- oder Rezidivtumoren mit Ziel einer erneuten Kuration.
- Wahrscheinlichkeit eines Tumorrezidiv in den ersten 1–2 Jahren am höchsten.
- Wahrscheinlichkeit von Zweittumoren nimmt in Abstand zur ersten kurativen Behandlung zu.
- Häufigkeit von Lokalrezidiven oder Fernmetastasen abhängig vom Stadium der Erstdiagnose (Tab. 122.17).
- Es ist nicht ganz geklärt, ob es einen Vorteil von Nachsorgen mit festem Zeitplan gibt zu symptombezogenen Nachsorgen.
- In der Regel finden Nachsorgen in den ersten 2 Jahren nach Kuration alle 3 Monate statt sowie im Anschluss daran alle 6 Monate bis zu 5 Jahren.
- Es sollten regelmäßige bildgebende Kontrollen erfolgen, z.B. mittels Röntgen-Thorax sowie ggf. CT-Thorax.
| Tab. 122.17 Häufigkeit von Lokalrezidiven oder Fernmetastasen. | ||
Verlauf und Prognose
- Das Lungenkarzinom gehört zu den prognostisch ungünstigsten Karzinomen.
- 5-Jahres Überlebensrate bei Männern 16% und bei Frauen 21%.
- Zahl der krebsbedingten Todesfälle bei Männern etwa 30000/Jahr und bei Frauen etwa 15000/Jahr in Deutschland.
- Die Prognose wird sich wahrscheinlich in den nächsten Jahren aufgrund der neuen Immuntherapien deutlich verbessern.
Literatur
Quellenangaben
- [1] Wittekind C. TNM: Klassifikation maligner Tumoren. Weinheim: Wiley-VCH: 2017 Suche in: PubMed Google Scholar
- [2] Oken MM, Creech RH, Tormey DC et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5: 649-55 Suche in: PubMed Google Scholar
- [3] National Cancer Institute. Common Terminology Criteria for Adverse Events v3.0 (CTCAE) (2006). Im Internet: https://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/ctcaev3.pdf; Stand: 05.05.2023
- [4] Brahmer J, Reckamp KL, Baas P et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer. N Engl J Med 2015; 373: 123–135. DOI 10.1056/NEJMoa1504627 Suche in: PubMed Google Scholar
- [5] Schütte W, Blankenburg T. Diagnostische und therapeutische Konzepte bei Patienten mit Bronchialkarzinom und malignem Pleuramesotheliom. Bremen: UNI-MED; 2012 Suche in: PubMed Google Scholar
- [6] Goeckenjan G, Sitter H, Thomas M et al. Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms. Interdisziplinäre S 3-Leitlinie der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin und der Deutschen Krebsgesellschaft. Pneumologie 2010; 64 (Suppl. 2): S 23-S 155 Suche in: PubMed Google Scholar
- [7] Antonia SJ, Villegas A, Daniel D et al. Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med 2017; 377(20): 1919–1929. 10.1056/NEJMoa1709937 Suche in: PubMed Google Scholar
- [8] Horn L, Mansfield AS, Szczesna A et al. First-Line Atezolizumab plus Chemotherapy in Extensive-Stage Small-Cell Lung Cancer. N Engl J Med 2018; 379 (23): 2220–2229. DOI: 10.1056/NEJMoa1809064 Suche in: PubMed Google Scholar
- [9] Paz-Ares L, Dvorkin M, Chen Y et al. Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomized, controlled, open-label, phase 3 trial. Lancet 2019; 394: 1929–1939 Suche in: PubMed Google Scholar